Какво представлява отровата на медузите Ируканджи, как действа и защо все още няма универсална противоотрова?
Типът Cnidaria е много стар и разнообразен биологически тип, който притежава широк спектър от биологично-активни субстанции, които могат да бъдат наречени токсини. Токсините на клас Anthozoa, който е отделен клас от Cnidaria могат да бъдат разделени на две химически много различни групи, а именно полипептидни токсини, изолирани от морски анемони, и дитерпени, изолирани от октокорали. Белтъчните токсини на Cubozoa и Sciphozoa са най-загадъчните токсини в този тип, и въпреки големите усилия в последните няколко десетилетия, все още малко се знае за тяхната природа. Много малко от тези големи и относително нестабилни белтъци са изолирани.
Факт е, че изучаването на отровата на кубовидните медузи, която причинява ируканджи синдрома, е все още в зародишно развитие. Има и опити за създаване на противоотрова, но досега откритите такива са или частично ефективни при хора, или нямат ефект. Това се дължи на сложния състав на отровата, на вариациите ѝ при различните видове, както и на комплексното ѝ действие върху човешкия организъм.
Отровите в животинското царство
За да може поне до някъде да изясним уникалността на отровите на тези медузи, причиняващи ируканджи синдром, ще се спрем накратко на отровите в животинското царство, които са много по-добре проучени в еволюционно, фармакологично, биохимично и генетично отношение, и следователно тяхното физиологично действие върху човек.
В последните години с развитието на т. нар. „омик“* технологии (цел на омик-технологиите е колективното характеризиране и количествено определяне на съвкупност от биологични молекули, които определят структурата, функцията и динамиката на един организъм или организми. Напр.: Геномика-гени, Протеомика-белтъци, Метаболомика-метаболити, Липидомика-липиди, Интерактомика-взаимодействието на различни биологични молекули) вече има налични данни за състава на различните отрови, разкривайки значителната комплексност в процесите, отговорни за генерирането на генетичното и функционално разнообразие. Отровите предлагат интересни и често уникални вниквания в няколко коренно различни области на биологията, които включват фармакология (разработване на лекарства), имунология (терапия при отравяния) и структурна биология (белтъчно свързване и взаимодействия). Подкрепящи науки към тези области са екологията и еволюцията на отровните животни и на техните отрови. Отровите осигуряват непаралелни модели за взаимодействията между хищник и плячка, влиянието на естествения отбор, и случаите на молекулярна еволюция и белтъчна неофункционализация.
В широк смисъл отровата може да бъде определена като секрет, произведен от специализирана жлеза в дадени животни, която се доставя в жертвите чрез нанасяне през рана, независимо колко малка може да бъде тя. Отровата съдържа молекули, които нарушават нормалните физиологични и биохимични процеси, така че да улесни храненето или защитата на произвелото я животно. Тя има няколко функции в животинското царство, като най-разпространено е включването и в хранителните взаимоотношения между хищник и плячка. Друга функция на отровата е защитна адаптация и потенциални вътревидови конфликти (при птицечовката например).
Повечето животински отрови са комплексни смеси от биоактивни компоненти. Те обикновено обхващат смеси от белтъци и пептиди (с широкото название токсини), соли и органични компоненти, като аминокиселини и невромедиатори. Най-разпространени са белтъчните компоненти, които са разтворими във вода. Защитните отрови, като тези на различни видове риби, на пчели и др., са силно опростени и консервативни. Обикновено тяхното първоначално въздействие е мигновено със силно локализирана болка. За разлика от това, отровите на ловците са много по-сложни и най-често силно вариабилни в състава си и във физиологичните си ефекти.
В допълнение на развитието на устойчивост към отровата на даден вид от неговите естествени жертви, идва и сериозната метаболитна цена, която животното трябва да плати, за да произведе тази отрова. Това води до увеличена метаболитна скорост след екстракция на отровата. Еволюционните резултати са поведенчески адаптации за отделяне на по-малко, или пък точно, колкото е необходимо количество отрова за парализиране на жертвата. При редица змийски линии, които еволюционно са се приспособили към плячка, която не се бори (например яйца) се развива атрофия на отровния апарат и дегенерация на гените за образуване на токсини.
За много токсини се смята, че се развиват чрез т. нар. процеси на „раждане и смърт“ в генетичната еволюция, чрез които генът, кодиращ нормален „физиологичен“ белтък (обикновено такива включени в ключови регулативни процеси и биоактивности) се дуплицира, като дуплицираното копие се експресира селективно в отровната жлеза. Тези родови физиологични белтъци се експресират в редица тъканни типове и изявяват редица близки активности. Веднъж рекрутиран определен ген в отровната жлеза, търпи допълнителна генетична дупликация, свързана с белтъчна нео- и/или субфункционализация, което обикновено има за резултат големи мултилокусни генетични семейства. Тези семейства кодират токсини, които изявяват различни функционални активности и ефективности. Филогенетични изследвания в последните години на хомолози на токсинови гени, експресирани в други тъкани, осигуряват доказателства, че токсините могат да бъдат „реверсивно рекрутирани“ от отровната жлеза в други тъкани, докато пък други могат да се ко-експресират в отровната жлеза и в другите тъкани.
Еволюцията на отровните токсини чрез отбора, наречен „раждане и смърт“ се съпровожда със силни доказателства за ускорена еволюция и положителен отбор. Редица проучвания показват, че положителният отбор действа предимно на аминокиселинните остатъци, които са експресирани на повърхността на белтъчната макромолекула. Чрез поддържане на силно стабилна структурна сърцевина, модификацията на повърхностните остатъци улеснява неофункционализацията на токсина чрез модифициране на взаимодействието между белтъка и прицелната молекула (чрез увеличаване на афинитета към съществуващи прицели или пък улесняване таргетирането на нови рецептори). Генетичната дупликация, положителния отбор и белтъчната неофункционализация изглежда работят заедно за осигуряване на еволюционни промени, които позволяват адаптиране на отровите към различни жертви, както и към защитната адаптация на жертвите към тези отрови.
Трябва да се отбележи, че рекрутирането на гени за експресия в отровната жлеза не е свързана само с генната дупликация. Някои идентифицирани токсинови гени просто се модифицират, сплайсват алтернативно, или се генерират чрез промени в структурата на домените. Екологичната роля на отровите изглежда свързана с еволюцията на начина на използване на токсина. Например много от най-патогенните токсинови семейства на трофично отровни таксони са мултилокусни по природа.
Отровите са един от най-сложните биохимични секрети в животинското царство. Независимо от тази комплексност, последни проучвания показват забележителна степен на конвергенция във физиологичното таргетиране на компонентите и на основните молекулярни строителни блокове, съединени в токсиновата строителна конструкция. Таргетите на действието на отровата включват основните физиологични пътища и видовете тъкани, които са силно кръвоснабдени. Интересно е, че конвергентното таргетиране измежду таксоните е общо и особено видимо за хемостатичната и неврологични системи, където компонентите на отровата рекрутират независимо в различните отровни линии, действайки върху един и същи молекулярен таргет. Токсините увреждат хемостазата чрез инхибиране или тригериране на стъпките от каскадата на коагулация, като причиняват хеморагия. Увреждането на невротрансимията, било то пресинаптично (Na+, K+ или Ca2+ канали) или постсинаптично (мускаринови и никотинови рецептори) също са се развивали конвергентно в редица случаи.
Най-интригуващата част от конвергенцията касае молекулите, селектирани за използване като скеле на токсините. Свойството на такива типове белтъци е стабилизирането на молекулярния скелет чрез широки цистеинови крос-връзки. Тази характеристика улеснява модифицирането на неструктурните аминокиселини и има за резултат широка белтъчна неофункционализация. Наблюденията върху токсиновата конвергенция осигурява моделна система за изследване на структурните, функционалните и регулаторни характеристики, които правят определени белтъчни системи отговорни за „токсичната“ роля в отровата, както и еволюционните промени, включени в промяната на даден физиологичен белтък в токсин.
Токсини в отровите кубомедузи и на същински медузи
За съжаление съставът на отровите от различни видове медузи няма нищо общо с този на различните други видове отровни животни. Освен това еволюцията на техните отрови е вървяла по съвсем друг клон, така че и еволюционно не може да се проследи каквато и да била връзка. За сега се смята , че токсините в техните отрови са нов и различен клас, най малкото защото не се наблюдават дисулфидни мостчета в техните белтъци.
Въпреки че, отровите от кубомедузи като цяло притежават сходни биологични активности, разнообразието на ефектите, причинени от различните видове показват, че те се различават по активността и състава на белтъците.
До сега са охарактеризирани подробно няколко различни белтъка. Предполага се, че кубомедузите синтезират най-малко една група хомоложни биоактивни белтъци, които са лабилни, алкални по характер, хемолитични и близки по молекулна маса (42 – 46 kDa). Непознатите токсини от тези медузи също са потенциално летални и причиняват кожна болка, възпаление и некроза. Анализ на вторичната структура и непреки хомоложни предположения за белтъчната им структура предполагат, че токсините на тези медузи могат да действат като токсини, образуващи α-пори. Въпреки че няколко десетилетия се провеждат биохимични, фармакологични, и токсикологични проучвания, белтъците изолирани от тези медузи остават много малко на брой, нещо повече механизмите им на действие, за предизвикване на ируканджи синдрома все още остават неясни. Процесът, свързан с биохимичното охарактеризиране на тези белтъци се затруднява от следствия свързани с тяхната нестабилност и хидрофобност, както и вариабилността на източниците, екстракционните методи и аналитичните техники. В последно време има напредък в молекулярното характеризиране на белтъци от отровата на кубомедузите, включващо кДНК клониране и секвениране на пет хомоложни протеина, които принадлежат към ново семейство токсини от кубомедузи.
Биохимична характеристика на проблематичните белтъци в отровите
Основните проблеми, с които се сблъскват изследователите при характеризирането на биоактивните белтъци в състава на отровите на тези медузи са: тяхната нестабилност; склонността им да агрегират/дисагрегират и да адхезират по препаративните повърхности или хроматографския разтвор. Трудностите, срещани при характеризирането на отровите на кубомедузите се подчертават от наблюдаваната вариабилност, както и често получаването на противоречиви резултати от независими изследователски групи. Различията в източниците на екстрахиране и/или екстракционните и фракциониращите техники също оказват влияние върху различията в резултатите. Например различните групи използват екстракти от цели тентакли, други от изолирани нематоцисти. Повечето учени смятат, че по-адекватно е използването на нематоцистни екстракти, по простата причина, че при отравяне медузите вкарват директно отрова само от нематоцистите. Екстрактите от тентакли при всички положения съдържат допълнително белтъци, които не навлизат в кръвотока при отровно опарване. Допълнителни усложняващи обстоятелства при биохимичното характеризиране на отровите са неточното определяне на вида и подвидовете на медузите. Още повече, последни проучвания показват, че отровите изолирани от нематоцисти от чадърчето и от тентаклите на C. barnesiсе различават по своя токсичен състав. Онтогенетичната промяна в състава на отровата е свързана с промяната на жертвите при ювенилните и при възрастните медузи. Наблюдавани са необясними за сега различия в отровния състав от различни групи нематоцисти, изолирани отC. fleckeri, както и от видове събирани от различни географски райони.
Изолиране и пречистване на активните белтъци от кубомедузи
Въпреки че сравнението на експерименталните данни е трудно, изглежда отровата от C. fleckeriпритежава различни белтъци с летален характер, които варират по своята молекулна маса. Леталните фактори се свързват с кардиотоксичност, и често, но не винаги с литична активност на белтъците. Белтъци с относително ниска молекулна маса (10 – 30 kDa) са общи за SDS-PAGEбелтъчните профили на летални хроматографски фракции. Наблюдавани са също белтъци с по-висока молекулна маса (40 – 50 kDa). И накрая се наблюдават два белтъка с молекулна маса 120 и 70 kDa, които се свързват с дермонекротичната активност на отровата, която е допълнителна към хемолитичната и летална активности.
В отровата на C. marsupialisсе наблюдава цитолизин с молекулна маса 107 kDa, който притежава хемолитична активност към овчи еритроцити, но не и към човешки и към заешки такива. В друго проучване се наблюдава летален невротоксин с молекулна маса 120 kDaи три различни цитолизина (220, 139 и 36kDa) от нематоцистна отрова от същия вид медуза. Невротоксинът причинява парализа и смърт при раци, а хемолизините лизират човешки еритроцити.
Изолирани са частично пречистен белтък от тентакли на C. rastoni (pCrTX) и три силно токсични белтъка (CrTx-I, CrTX-IIи CrTx-III). Те притежават летална и хемолитична активност, предизвикват агрегиране на тромбоцитите (чрез увеличаване пропускливостта на мембраната за катйони), действат като Ca2+-зависими вазоконстриктори и увреждат механизмите на ъптейка/складирането на норадреналина.
Молекулните маси на CrTX –I, -IIи –III, определени чрез SDS-PAGEелектрофореза (40, 100 и 51 kDa), не се променят при редуцирани и нередуцирани условия, което предполага, че те не образуват вътрешно молекулни дисулфидни мостове. CrTXбелтъците не се оцветяват от данзилхидразин, което доказва, че те не са гликозилирани.
Малко се знае за състава на отровата на C. barnesi – основната медуза набедена за причинител на симптомите на ируканджи синдрома. Чрез SDS-PAGEелектрофореза са определени 4 основни белтъка (40, 45, 80 и 106 kDa) и няколко по-маловажни такива. Трябва да се отбележи, че белтъкът с молекулна маса 106 kDaе идентичен с цитолизина, изолиран от отровата на C. marsupialisи сCrTX, изолиран от отровата на C. rastoni. В сравнение с това, екстракт от нематоцисти, изолирани от чадърчето на тази кубомедуза, съдържа допълнителен белтък с молекулна маса 40 kDa, който е кръстосано-реактивен с обща противоотрова срещу отровата на C. fleckeri.
В последните години проучванията на хидромедузи и на карибдеиди показват наличието на един или два алкални белтъка с еднакви молекулни маси (40 – 60kDa), които доминират в SDS-PAGEпрофилите на екстракти от нематоцисти или тентакли. До сега това са единствените белтъци от кубомедузи, които са успешно клонирани и секвенирани.
Ново семейство на биоактивни белтъци, изолирани от кубомедузи
Първите секвенирани белтъчни токсини от кубомедузи са CrTX-Aи CrTX-B, които са изолирани от отровата на C. rastoni. В последствие са изолирани и характеризирани белтъчни токсини от още три вида кубомедузи – C. alata, C.quadrigatusи C. fleckeri.
Не се наблюдава значима хомоложност в аминокиселинната последователност на токсините от кубомедузи и на други известни токсини (от други отровни животни), което предполага, че те принадлежат към ново семейство биоактивни белтъци. Характерно за токсичните белтъци, изолирани от отровите на кубомедузи, е че те са лабилни, алкални белтъци (42-46 kDa), които проявяват силна хемолитична активност. Анализи на биоактивността на определени токсини показват, че те също така са летални, причиняват локализирана болка, възпаление и дерматонекроза.
Имунолокализационни проучвания на токсините, изолирани от C. rastoni (CrTX-A, -B), показват, че CrTX-Aе локализиран основно в нематоцистите, докато CrTX-Bе ограничен в тентакловата тъкан. Кодиране чрез единична кДНК и на двата белтъка, предполага че CrTX-Bсе синтезира в тентаклите, модифицира се до CrTX-A, след което се транспортира в нематоцистите.
Две години по-късно е изолиран, клониран и секвениран основния белтък, който се съдържа в отровата на C. quadrigatus (CqTX-A). Това е белтъкът, който се открива в най-голямо количество в нематоцистната отрова, на базата на което може да се предположи, че той е причинителят на фаталните последствия, след ужилването на тази медуза. Въпреки че C. quadrigatus, се смята за по-опасна за хора от C. rastoniиC. alata, при сравняване на леталните хемолитични активности на пречистените токсини от отровите на трите медузи, се вижда, че CqTX-Aима по-слаба такава отCrTX-Aи CaTX-B. Това частично противоречие може да бъде обяснено с факта, че C.quadrigatusима по-голям брой тентакли, които са и с по-голяма дължина от тези на другите две медузи и следователно може да инжектира по-големи дози от токсина.
За разлика от горните от нематоцисти на C. fleckeriса изолирани два хомоложни белтъка (CfTX-1, -2), за които са изолирани и две отделни кДНК, което ясно показва, че двата белтъка не се кодират в един и същи ген. Тези два белтъка трудно могат да се разделят чрез електрофоретични или хроматографски методи. Двата белтъка обаче, могат да бъдат едновременно пречистени чрез така наречените size-exclusionметоди или йонообменна хроматография. В природни условия, измерената молекулна маса на успоредно пречистените белтъци е 370 kDa, което показва склонността им да олигомеризират и да образуват мултимерни четвъртични структури. Хемолитичната активност на CfTX белтъците показва сигмоидална крива доза-отговор, която е характеристична за стехиометрични цитолизини.
Структурните особености на токсините на кубовидните медузи все още трябва да бъдат изяснявани, въпреки че няколко метода за анализ на аминокиселинната последователност предсказват, че пет токсина от кубомедузи имат аналогични модели на вторични структури. Общите изводи от моделните методи е, че първите 300 аминокиселини на токсичните белтъци са доминирани от α-спирали, примки и вероятно един β-лист, докато С-крайните области се доминират най-вече от β-листове и примки. Следователно двете области, които са със значително различна топология могат да се свържат с отделни домени. На базата на предположения за вторичната структура на петте токсина от кубомедузи се наблюдават най-малко две общи структурни характеристики, които биха могли да са свързани с потенциалната цитолитична активност на белтъците. Първо са предположени амфифилните α-спирали в N-крайната област на всеки белтък, и второ един общ регион, който пронизва мембраната (TSR1), съдържащ една или две хидрофобни α-спирали. При липсата на 3-D структурна информация не са видими модели на силно консервативни катйонни остатъци, обграждащи амфифилните α-спирали или хидрофобните области на TSR1, каквито са описани за редица други цитолитични токсини.
Потенциалното включване на α-спирали предполага, че токсините на кубомедузите биха могли да действат като образуват α-пори, като техните домени, образуващи порите се състоят от една или две, до снопче спирали. Още повече непряк хомоложен белтъчен анализ предполага, че два от белтъците на кубомедузите (CaTX-Aи CfTX-2) имат слабо структурно сходство с α-порообразуващите инсектицидни δ-ендотоксини, произвеждани от Bacillusthuringiensis.
Цитолизини, изолирани от кубомедузи
Различните кубомедузи продуцират различни цитолитични белтъци. От C.fleckeriдопълнително е изолиран и кардиотоксин с молекулна маса 20 kDa. Този белтък е летален за мишки, птичи кардиомиоцити и повлиява йонната пропускливост на двойнолипидните мембрани чрез образуване на едновалентни катйонни канали. Мембраните са съставени от холестерол и фосфатидилхолин. При третиране на плъши кардиомиоцити с отрова, извлечена от C. fleckeriсе наблюдават многобройни овални лезии на мембраната с диаметър приблизително 50 до 80 nm. Има доказателства обаче, че хемолитичната активност на отровата на тази медуза не е отговорна за леталните ефекти като цяло. Хемолизините на кубомедузите проявяват различни афинитети към еритроцитите от различни видове. Например хемолизинът, изолиран от C. marsupialisповлиява хемолитично много по-силно еритроцити от овце, отколкото човешки и заешки еритроцити.
Биохимични проучвания показват, че хемолизините, изолирани от отрова на кубомедузи, се стабилизират в разтвори с високо солево съдържание, като активността им зависи от съдържанието на двувалентни катйони. Например активността на отровата, извлечена от C. alata, зависи от присъствието на Mg2+,Ca2+ или Zn2+ и е оптимална при концентрация от 10 mMCa2+ или Mg2+.
Хемолитичната активност на отровата, извлечена от C. alataсе инхибира от присъствието на някои въглехидрати, и най-вече на D-лактозата. Хемолитичната активност на отрова, извлечена от книдария се инхибира също така от някои въглехидрати (сиалова киселина, β-метилгалактопиранозид) и липиди (сфингомиелин и фосфатидилинозитол). Още повече еритроцити преинкубирани с определени гликозиди (невроинидаза и β-галактозидаза) са значително по-малко податливи на лизиране от хемолизина изолиран от C. marsupialis. Това предполага хипотезата, че въглехидратните части по повърхността на клетъчните белтъци са включени в цитолитичния механизъм на действие. Следователно може да се смята, че има кооперативен механизъм на действие, който включва свързване на токсините с определени въглехидрати и липиди по клетъчната повърхност.
Ефекти на токсините от кубомедузи
Chironexfleckeri
Въпреки че, леталните компоненти от отровата на тази медуза не са недвусмислено идентифицирани, всички те продуцират едни и същи ефекти при интравенозно инжектиране, т.е. първоначално повишаване на кръвното налягане, което е последвано от хипотензия. Развива се брадикардия, която е последвана в рамките на минути от атрио-вентрикуларен блок. Наблюдава се вазоконстрикция, след което сърцето спира в състояние на систола. Редовна находка също така е респираторен арест и се предполага, че е с произход от централната нервна система. Интересно е, че експериментални животни оцеляват след инжектиране на големи дози от отровата интраперитонеално, подкожно и интрадермално. Ефектите от отровата на C. fleckeriса много подобни на тези на еквинатоксините от морски анемони, инжектирани invivoна изолирано сърце от плъх, което предполага, че промяната на пропускливостта на мембраните и последващото навлизане на Na+ иCa2+ йони вътре в клетките е важен механизъм за леталните ефекти на токсините. Наблюдава се увеличено навлизане на Na+ в кардиомиоцити след третирането им с отрова от C. fleckeri. Този процес е последван от навлизане на Ca2+, вероятно заради активирането на Na+/Ca2+ помпа.
За да стане малко по-ясен евентуалния начин на образуване на α-порите от тези токсини, накратко ще обясним начина на действие и структурата на equinatoxinII, изолиран от морски анемони.
EquinatoxinII (EqtII) принадлежи към уникално семейство на 20 kDaпорообразуващи белтъци от морски анемони. Тези токсини се свързват преференциално към мембрани съдържащи сфингомиелин и образуващи катйон-селективни пори чрез олигомеризация на три до четири мономера. Свързването на този токсин е двустъпков процес, отделно медииран от две области на молекулата на белтъка. Ароматният клъстер, включващ триптофан 112 и 116 медиира първоначалното свързване, което е предпоставка за настъпване на следващата стъпка. Стерично покриване на ароматния клъстер или мутация на триптофани 112 и 116 до фенилаланин значително намалява токсин-липид взаимодействието. Втората стъпка се подпомага от N-крайната амфифилна спирала, която се транслоцира в липидната фаза на мембраната. Двете стъпки се разграничават чрез използването на двоен цистеинов мутант, като N-крайната спирала се фиксира към белтъчната сърцевина с дисулфиден мост. Накрая, чрез потопени в мембраната „гасители“ се вижда, че токсинът не се вмъква дълбоко в мембраната.
Насочването и свързването на белтъците към мембраната е една от ключовите стъпки за осъществяване на много клетъчни процеси. Белтък-мембранните взаимодействия са интензивно изучавани в последните години с много различни примери на белтъци и мембрани. Взаимодействията могат да бъдат стартирани на липидно-водната повърхност чрез така наречените липидни „котви“, електростатични сили, ароматни или алифатни остатъци, намиращи се на повърхността. В сравнение с белтък-белтъчните взаимодействия, взаимодействията между белтък и мембрана са по-слабо описани.
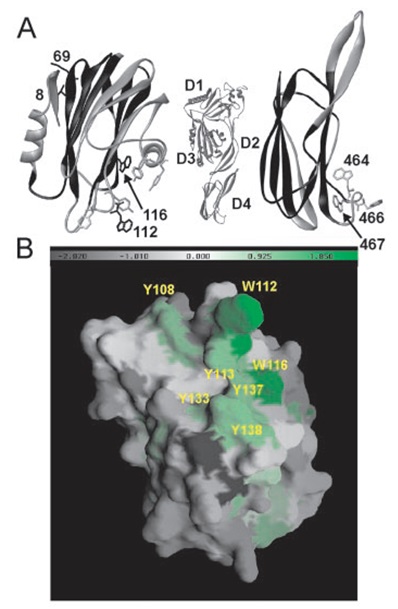
Една група белтъци, взаимодействащи с липидните мембрани са порообразуващите токсини (poreformingtoxins (PFT)), които се свързват с мембраните преди да предизвикат токсичните си ефекти чрез образуване на трансмембранни пори. Най-изучената група от порообразуващите токсини са бактериалните токсини, тъй като те включват важни вирулентни фактори. Характеризирани са малко на брой еукариотни порообразуващи токсини, като изключение правят актинопорините (цитолизини открити в морски анемони). Членовете на това семейство имат различни свойства от всички останали изучени порообразуващи токсини: те се състоят от 175 – 179 аминокиселинни остатъка, като не съдържат цистеинови такива; притежават pI>9.5; показват предпочитания към сфингомиелин-съдържащи мембрани. Актинопорините действат върху клетъчни и моделни липидни мембрани, образувайки катйон-селективни пори с хидродинамичен диаметър около 2 nm. Механизмът на образуване на порите включва най-малко две стъпки: свързване на водоразтворимия полимер към мембраната; и последваща олигомеризация на три или четири мономера на повърхността на мембраната, което води до образуване на функционална пора. Броят на мономерите във финално образуваната пора е извлечен чрез крос-линк и кинетични експерименти. Предполага се, че N-крайните амфифилни α-спирали, които са добре запазени при актинопорините, участват в образуването на трансмембранния канал. Това предположение е подкрепено чрез кристалографски структурни изследвания и такива с ядрено-магнитен резонанс. Молекулата наEqtIIсе състои от хидрофобна сърцевина, съставена от β-сандвич, фланкирана от всички страни с α-спирали. Първите 30 N-крайни остатъка, включващи амфифилната спирала, образуват най-големия сегмент на молекулата, който може да възприеме различни структури без да наруши общото ѝ нагъване. Друга интересна черта на тази молекулна структура е наличието на клъстер на открити ароматни аминокиселинни остатъци по повърхността на молекулата, обхващащиTyr-108, Trp-112, Tyr-113, Trp-116, Tyr-133, Tyr-137 и Tyr-138 (фиг. 1). Те вероятно играят роля за мембранното разпознаване и свързване, тъй като ароматните остатъци притежават афинитет към липидно-водната повърхност. На базата на тези наблюдения може да се формира хипотезата, че токсинът първоначално се свързва с мембраната чрез ароматния си клъстер.
Фиг. 1 Триизмерна структура на EqtIIи структурно подобния четвърти домен на перфринголизина.
А. Модели на EqtII (ляво)и четвъртия домен на перфринголизин O (PFO) (дясно). Моделът на цялата молекула перфринголизин O е показан в средата с обозначени домени от 1 до 4. Областите, които са определени като структурно еднакви са подчертани в черно. Показани са страничните вериги на ароматните аминокиселини от консервативните ароматни клъстери на EqtIIи PFO. Аминокиселините на EqtII, които са мутирани в това проучване са показани в черно и са указани с номера.
В. Показана е повърхността на ароматната част на EqtII. Аминокиселините са оцветени според експериментално определена скала за разделяне на липидно-водната повърхност (скала на White–Winley). (HongQ., etal., 2002, JBC)
При следващата стъпка N-терминалната спирала се транслоцира от повърхността на β-сандвича в мембраната, и накрая преминава в липидния бислой, образувайки катйон-селективна пора.
Актинопорините нямат сходства на аминокиселинните си последователности с които и да било други известни белтъци. Наблюдавано е структурно сходство (и много слабо сходство в аминокиселинната последователност) с таумин (thaumin) и с четвъртия С-краен домен на перфринголизина (PFO). Тези белтъци са богати на β-листове и тяхното сходство с EqtIIсе ограничава в областта на β-сандвича. PFOе репрезентативен за групата токсини, които са холестерол-зависими цитолизини (cholesteroldependentcytolysin (CDC)). Той е белтък, който се състои от 500 аминокиселинни остатъка, състоящ се от 4 домена. Може да образува огромни пори с диаметър до 150 nm, съставени от до 30 мономера. PFOсе свързва с мембраните чрез четвъртия си домен, който съдържа ундекапептидна последователност (последователност от 11 аминокиселинни остатъка), която е силно консервативна за различните мембрани на CDCи е еднаква с богатата на триптофан област на EqtII. Триптофаните, намиращи се в ундекапептидната област имат роля за свързване с мембраната. Тези триптофанови остатъци не се наместват дълбоко в липидния бислой на мембраната. Въпреки че първата стъпка на взаимодействие с мембраната при тези токсини е сходна, което се потвърждава от наличието на триптофан и сходството на структурите на мембранно свързващия домен, то втората стъпка на порообразуването е различна.
Показано е, че най-важната област за свързване с мембраната на EqtIIе ароматният клъстер. Мутацията на откритите Trp-112 и Trp-116 към фенилаланин значително намалява свързването с мембраната. Чрез създаване на дисулфидни мостове, които предотвратяват дислокацията на спиралата от тялото на белтъчната молекула могат да се разделят двете стъпки на порообразуването: 1) първичното свързване към мембраната; 2) въвеждане на N-крайната спирала в липидния бислой на мембраната. Последното води до създаване на допълнителни контакти с мембраната и до необратимо включване на белтъка. Първоначалната стъпка на включване на EqtIIнапомня на тази на CDCтоксините, което означава, че те имат не само структурно, но и функционално сходство.
Разработени са нови методи за събиране на нематоцисти, обвързани с нови процедури за изолиране и пречистване, осигуряващи нови субстанции, чиито резултати при интравенозно прилагане са почти същите, които следват след прилагане на по-малко пречистени фракции при по-раншни експерименти.Ramasami и сътр. (2005) показват, че отрова от C. fleckeriпричинява двуфазни ефекти върху артериалното кръвно налягане, което накрая води до циркулаторен колапс. Тези ефекти не могат да се потиснат напълно след въвеждане на противоотрова, но профилактичните ефекти са достатъчни за да предотвратят смъртните случаи при 40% от плъховете. Едновременното въвеждане на MgSO4предотвратява кардиоваскуларен колапс и смърт при експериментални животни, но не ги предотвратява, когато се развие преди това. Въпреки че отрова от пречистени нематоцисти причинява само хипотензивен отговор, екстракти от тентакли без нематоцисти причиняват хипертензивен отговор, който обаче може да бъде предотвратен от prazosin. Този препарат е α-адренергичен блокер, специфичен за α1-рецепторите, които се намират по гладките мускулни клетки на кръвоносните съдове. Там те отговарят за вазоконстрикторното действие на норепинефрина.
При нематоцистната отрова се наблюдава кардиоваскуларен колапс при 2 от 5 третирани животни. Показано е още, че отровата от C. fleckeri предизвиква продължителни контракции на аортни пръстени с наличен ендотел, както и с премахнат такъв.
Chiropsalmusquadrigatus
Ранни проучвания, направени с отрови и екстракти от отрови на C. quadrigatusпоказват, че ефектите им са идентични, но по-слаби от тези на токсичните субстанции на C. fleckeri. Същите ефекти са наблюдавани и при жертви ужилени от тези медузи. Три десетилетия по-късно (след 2005 г.) Ramasamiи сътр. Наблюдават кардиоваскуларен колапс, който не се повлиява от противоотровата създадена заC. fleckeri, приложена самостоятелно или в комбинация с MgSO4 (т.е. противоотровата и магнезиевия сулфат не предотвратяват сърдечния арест и хипотензията, причинени от инжектиране на отрова от C. quadrigatusпри експериментални животни). Ефектите от отровата са устойчиви също така наprazosin, ketanserinи изкуствено дишане (Ramasamiи сътр., 2005). Ketanserin е препарат с афинитет към редица рецептори, свързани с G-белтъците. Той е високоселективен антагонист за серотонин 5-НТ2А рецепторите и има средна селективност за 5-НТ2С рецепторите и α1-адренергичните рецептори, както и много висок афинитет за хистамин Н1 рецепторите.
Показано е, че токсините от C. quadrigatusиндуцират Са2+ и ендотел зависими контракции на аортни пръстени и увеличаване на тензията в лявото предсърдие при плъхове. При зайци отровата предизвиква преходна хипертензия, която е последвана от хипотензия и брадикардия. Артериалният поток намалява и животните умират заради настъпване на сърдечен арест. Тези ефекти могат да бъдат предотвратени от блокери на Са2+ йонни канали. Отрова екстрахирана от нематоцисти и инжектирана интравенозно на анестезирани плъхове предизвиква рязка хипертензия и брадикардия. Препаратите prazosin, атропин и ендотелинови рецепторни антагонисти не могат да предотвратят тези ефекти при плъхове in vivo. Блокатори на Са2+ канали (никардипин) предотвратяват ефектите на токсините и експерименталните животни оцеляват (Noguchiи сътр., 2005).
Carukiabarnesi (ируканджи)
Тази медузка вероятно е най-добре познатата карибдея заради потенциално смъртоносния „ируканджи синдром“, който се развива след опарване от нея. При този синдром най-живото застрашаващият ефект е ужасяващата хипертензия, която може да има за последствие остра сърдечна недостатъчност, съпроводена с белодробен едем и/или церебрална хеморагия. Още няма ясни доказателства далиC. barnesiе единствения причинител на синдрома „ируканджи“. Фармакологията на тази отрова слабо се познава. Предполага се, че отровата причинява силно увеличаване на количеството на катехоламините в кръвообращението, което води до горепосочените ефекти. Интравенозно въвеждане на фентоламин или подезични нитрати могат да подобрят или да обърнат симптомите. Прилагането наMgSO4 намалява болката и хиперадренергичните симптоми. Тъй като сърдечната недостатъчност може да предшества хипертензията, директното кардиотоксично действие на токсина също е вероятно, но е наблюдаван само положителен инотропен ефект върху изолирани артерии от плъх и морско свинче. Увеличената пропускливост за Na+-йоните вероятно тригерира освобождаването на катехоламини, тъй като тетродотоксинът блокира тахикардията на изолирани артерии от плъх и от морско свинче.
Симптомите и клиничното развитие на ируканджи синдрома са много различни от симптомите на ужилване от C. fleckeri, което показва, че токсините, продуцирани от тези два вида са различни, въпреки че компонентите от противоотровата за токсините на C. fleckeriсе свързват с компоненти от отровата на C. barnesi.
Carybdea rastoni; Carybdea alata; Carybdea marsupialis.
Частично пречистен токсин (pCrTX), изолиран от C. rastoniпредизвиква Са2+-зависими контракции в аорта от плъх. Такива не се наблюдават, когато разтворът е без наличие на калциеви йони, или след предварително третиране на аортните отрязъци с блокери на калциевите йонни канали. Тетродотоксинът няма ефект приpCrTX, но при промиване на лентичките от аортата с разтвор с ниско съдържание на Na+, значително намалява и количеството на контракциите. В относително малки концентрации (10-8 – 10-7g/ml) токсинът причинява контракция на аортата на плъх и на морско свинче, но при по-високи концентрации (10-7 – 10-6g/ml) релаксира аортата, която е преконтрахирана с норепинефрин. Релаксацията се предотвратява от метиленово синьо или при премахване на ендотела, което показва, че pCrTXиндуцираната релаксация се причинява от освобождаването на ендотелин релаксиращият фактор (endotheliumderivedrelaxingfactor (EDRF)).
Показано е също, че pCrTXе мощен активатор на тромбоцитите. Концентрацията, която дава 50% агрегиране на тромбоцитите е 1.8Х10-7g/ml от този токсин, докато колагенът, който дава същия ефект трябва да е в концентрация 2.3Х10-6. Ефектът на pCrTXе калциево-зависим, но блокерите на калциевите йонни канали са неефективни за предотвратяване на агрегирнето на тромбоцитите. Предполага се, че увеличената катйонна пропускливост на тромбоцитите в следствие на действието на токсина е на базата на безразборно деполяризиране на тромбоцитната мембрана. Пречистени токсини от C. rastoni– CrTX – I, -II, -III, получени от тентакли, също агрегират тромбоцитите чрез увеличаване на катйонната пропускливост, допускайки навлизане на Ca2+ йони.
Бъдещи проучвания
Молекулярното характеризиране на токсични белтъци от кубомедузи е в зародиш, като до сега е охарактеризирана, успешно клонирана и секвенирана само малка група от такива хомоложни белтъци.
Белтъците от новооткритото семейство на токсините на кубомедузите са изключително интересни, защото те са мощни цитолизини с потенциал да бъдат летални и да причиняват кожна болка, възпаление и некроза. Токсините също така са най-изобилните белтъци в нематоцистните отрови и в тентакловите екстракти, което предполага, че те биха могли да са основната причина за проявените ефекти при хората. До сега са установени само леталните и локализирани ефекти на CrTX-A при системи на бозайници. Необходими са още проучвания, за да се изясни дали другите хомоложни токсини проявяват същите ефекти. Необходимо е и сравнително проучване на свойствата и на нивата на експресия на токсините на кубомедузите, които могат да помогнат да се обяснят вариациите в биологичните ефекти, причинени от отровите на различни видове кубомедузи, и най-вече родовеCarybdeidaи Chirodropida.
Механизмите, стоящи в основата на биологичната активност на токсините на кубомедузите са все още неизвестни. Предположения за вторичната структура обаче дават основание да се смята, че това семейство белтъци могат да действат като образуват α-пори, което повлиява пропускливостта на клетъчната мембрана. Това от своя страна разрушава нормалните трансмембранни йонни градиенти. Валидността на тази хипотеза обаче не може да бъде проверена без да бъдат проведени критични биохимични, фармакологични и структурни проучвания. Предстои да бъде изучен молекулярният механизъм на взаимодействие на токсините с клетъчните мембрани. Изследвания изисква и специфичността на свързването токсин-рецептор. Тъй като се натрупват все повече данни за секвенциите на хомоложни токсини на други кубомедузи, идентификацията на силно консервативни аминокиселинни остатъци и/или вторични структури, които са критични за механизма на образуване на пори могат да бъдат разграничени чрез насочена кДНК мутагенеза или химични модификации във функционални (експресионни) проучвания.
Трудностите, които се срещат по време на пречистването на биоактивните белтъци от кубомедузи са от основно значение при проучванията на техните отрови. Тези проблеми ограничават изследователите в предприемането на функционални и структурни проучвания, които са необходими за изясняването на молекулярните механизми на изолираните биоактивни белтъци. Продължаващата насока да се използват екстракти от изолирани нематоцисти, вместо интактна тентаклова тъкан изглежда, че ще успее да преодолее трудностите при сравнителните анализи на различните резултати при бъдещи изследвания. Проблемите свързани обаче с лабилността, неспецифичното свързване и лошото разделяне на белтъците по време на тяхното пречистване са по-сложни за преодоляване. Резултатът като цяло е намалено количество добив на чисти биоактивни белтъци. Технологията на рекомбинантната експресия може да предложи алтернатива на изолиране на белтъците от кубомедузи.
Многостранността на ДНК библиотеките не трябва да се подценява при откриването на нови хомоложни токсини от отровни организми. В момента се използват други протеомни методи за характеризиране на отровата от кубомедузи, които включват 2-Dгел електрофореза, пептиден мас-фингърпринтинг (пептиден пръстов отпечатък по маса) съчетан с единична масспектрометрия, и по-софистичния белтъчен анализ, който използва двойна масспектрометрия, която може да бъде свързана с течна хроматография.
Автор: гл. ас. д-р Теодора Вукова
Източник: nauka.bg